Korrosion: Unterschied zwischen den Versionen
Zur Navigation springen
Zur Suche springen
| Zeile 8: | Zeile 8: | ||
==Elektrochemische Korrosion== | ==Elektrochemische Korrosion== | ||
| − | + | {| | |
| − | + | |[[Bild:El_chem_korrosion.png]] | |
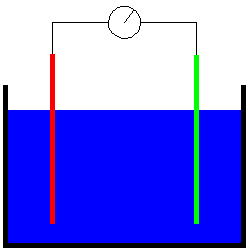
| − | + | |Elektrochemische Korrosion entsteht, wenn zwei verschiedene Metalle und ein sogenannter Elektrolyt vorhanden sind. Wasser ist z.B. ein solcher Elektrolyt. Durch das Wasser kann zwischen den Metallen ein Strom fließen, der die Zerstörung eines Metalles zur Folge hat. Ein Kupfernagel, der zufälligerweise in einer Dachrinne aus Zink liegen bleibt, zerstört auf Grund der elektrochemischen Korrosion diese Rinne. Weitere Beispiele wäre das Zinkrohr, das von Kupferschellen gehalten wird oder das Aluminiumfenster mit Kupferabdeckung. Als Regel gilt: <br> | |
| − | |||
<br> | <br> | ||
<div align="center"><font color="#cc0000">Das <b>edlere</b> | <div align="center"><font color="#cc0000">Das <b>edlere</b> | ||
| Zeile 17: | Zeile 16: | ||
</div> | </div> | ||
| + | |} | ||
<br> | <br> | ||
<br> | <br> | ||
Version vom 17. September 2008, 21:21 Uhr
Man unterscheidet:
* Chemische Korrosion * Elektrochemische Korrosion
Chemische Korrosion
Sie entsteht bei Berührung des Metalls mit Sauerstoff und Wasser
Elektrochemische Korrosion
| Metall |
Volt |
|
| Aluminium |
-1,7 |
unedel |
| Zink |
- 0.75 |
|
|
| |
| Eisen |
- 0.44 |
|
| Blei |
- 0.12 |
|
| Kupfer |
0.35 |
edel |
Je größer die Differenz zwischen den in der Spalte
'Volt' angegebenen Spannungen ist, desto zerstörerischer ist die
Wirkung der elektrochemischen Korrosion zwischen den beiden Metallen.
Korrosionsschutz
- richtige Wahl des Metalls
- Schutz vor korrosionsfördernden Stoffen
- Vermeiden von Feuchtigkeit